Gemeinsam gegen antibiotikaresistente Keime und Infektionserkrankungen
 Willkommen auf der Internetplattform des mre-netz regio rhein-ahr - das Netzwerk für Infektionsschutz
Willkommen auf der Internetplattform des mre-netz regio rhein-ahr - das Netzwerk für Infektionsschutz
Wir freuen uns über Ihr Interesse und laden Sie ein, auf den folgenden Seiten das Netzwerk und seine Arbeit näher kennenzulernen.
Um den zunehmenden Problemen mit multiresistenten Erregern (MRE) wirksam entgegenzutreten, wurde zum 1.9.2010 ein Bundesländer übergreifendes Netzwerk, das „mre-netz regio rhein-ahr“ gegründet. Dieses wird über Mittel seitens der beteiligten Kommunen finanziert und beinhaltet die Beschäftigung zweier gemeinsamer ärztlicher Koordinator*innen sowie die Nutzung der wissenschaftlichen Infrastruktur und Expertise des Universitätsklinikums Bonn bzw. des Instituts für Hygiene und Öffentliche Gesundheit zur Erreichung der Netzwerk-Ziele. Über die Zeit hat sich das mre-netz zu einem Netzwerk für Infektionsschutz entwickelt.
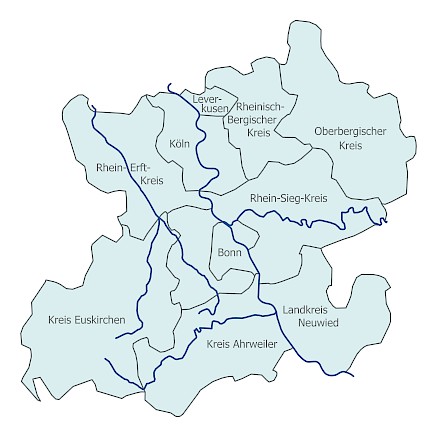
Mitglieder sind neben dem Universitätsklinikum Bonn der Rhein-Sieg-Kreis, der Oberbergische Kreis, der Rhein-Erft-Kreis, der Rheinisch-Bergische Kreis, die Bundesstadt Bonn, die Stadt Köln, die Stadt Leverkusen, der Kreis Euskirchen sowie aus Rheinland-Pfalz der Kreis Ahrweiler und der Landkreis Neuwied.
Aktuelles aus dem mre-netz
Alle News anzeigen
(Flyer Screenshot: GFO)
19.03.2024 7. GFO HYGIENE- & INFEKTIOLOGIETAG
In diesem Jahr findet der GFO Hygiene- und Infektiologietag bereits zum siebten Mal statt. In drei Sälen werden wir in mittlerweile gewohnter Weise am 19.06.2024 die verschiedenen Themen sortiert und...
weiterlesen

(Flyer Screenshot: Kliniken der Stadt Köln)
10.01.2024 12. Hygienetag Köln - Krankenhaushygiene nach einer Pandemie in Köln 2024
Der 12. Hygienetag Köln mit dem Titel "Krankenhaushygiene nach einer
Pandemie in Köln 2024" findet in diesem Jahr am 21.02.2024 von 13:00 bis 17:20 Uhr als Onlineveranstaltung statt. Alle Informatio...
weiterlesen

(Foto: mre-netz)
13.12.2023 Feierlichkeiten im mre-netz regio rhein-ahr
Am 08.12.2023 gab es für die Mitglieder des mre-netz gleich zwei Anlässe zum Feiern:
In einer gemeinsamen Sitzung im Institut für Hygiene und Öffentliche Gesundheit am Universitätskliniku...
weiterlesen

(Foto: pixabay)
03.11.2023 Hitze geht uns alle an!
Hier finden Sie viele Informationen und Projekte rund um das Thema Hitze. Schauen Sie doch gerne mal rein!















